一种缓冲系统及其相应液体制剂及其用途的制作方法
本公开涉及生物,具体地涉及一种缓冲系统及其相应液体制剂及其用途。
背景技术:
1、aav已成为人类基因治疗的新型工具,目前,aav制造生产、储存、运输以及给药过程中会经历反复动容,或冷藏储存,乃至常温存放。该情况会对aav的稳定性提出极大挑战,造成转导效率下降。与此同时,由于aav被应用的场景不断增加,不单单仅局限局部小剂量给药,故对于高剂量全身给药所造成的不良反应,应得到更多关注。近些年所上市产品,病毒滴度普遍维持在1×1013vg/ml左右,甚至更低,且溶液渗透压均维持在350mosm/kg以上,甚至更高,如uniqure公司推出的glybera以及biomarin公司所推出的roctacian等,这对于高剂量全身给药并不友好,会引起不必要的免疫反应,且会大大增加给药次数,对患者造成痛苦。
2、aav作为基因治疗载体在临床上的研究及应用不断增加,例如为避免肝脏毒性和肝癌隐患,血友病基因治疗必须探索更为安全且有效的aav载体及给药方式,改变aav药物在人体内的组织分布,使其成为一种具有显著安全性优势的基因治疗药物。
3、基于aav作为基因治疗载体在临床上的研究及应用不断增加的情况,目前所面临的挑战是由于开发制造、长期稳定性及给药途径大大限制了辅料与缓冲液选择,因此亟需开发设计一种具有兼顾稳定性,适用于不同给药途径及高浓度剂量且保证低渗透压的aav制剂处方。
技术实现思路
1、本公开的目的在于提供一种具有兼顾稳定性,适用于不同给药途径及高浓度剂量且保证低渗透压的aav制剂处方。
2、本公开第一方面提供了一种缓冲系统,所述缓冲系统包括可溶盐类物质、多元醇、ph缓冲液。
3、在另一可选例中,所述可溶盐类物质包括可溶一价金属盐。
4、在另一可选例中,所述可溶一价金属盐包括可溶钠盐。
5、在另一可选例中,所述可溶盐类物质包括可溶二价金属盐。
6、在另一可选例中,所述可溶二价金属盐包括可溶钙盐、可溶镁盐、可溶锌盐、可溶铜盐、可溶锰盐、可溶铬盐中的一种或多种。
7、在另一可选例中,所述多元醇包括蔗糖、甘露醇、甘油。
8、在另一可选例中,所述缓冲系统的ph值维持在7.0~8.0(例如7.0~7.6,或者,7.0~7.4)。
9、在另一可选例中,所述ph缓冲液选自下组的一种或任意几种缓冲液:pb缓冲液、hepes缓冲液。
10、在另一可选例中,所述多元醇为蔗糖。
11、在另一可选例中,所述多元醇为甘露醇。
12、在另一可选例中,所述多元醇为甘油。
13、在另一可选例中,所述可溶二价金属盐中的二价金属离子包括ca2+、mg2+、zn2+、cu2+、mn2+、cr2+。
14、在另一可选例中,所述可溶一价金属盐中的一价金属离子包括na+。
15、在另一可选例中,所述na+来源于nacl。
16、在另一可选例中,所述ca2来源于cacl2、ch3cooca。
17、在另一可选例中,所述mg2+来源于mgcl2、mg2so4。
18、在另一可选例中,所述缓冲系统还包括表面活性剂。
19、在另一可选例中,所述表面活性剂选自下组:f68、tween20、或其组合。
20、在另一可选例中,所述可溶盐类物质中的可溶一价金属盐的浓度为50~250mm,例如80~200mm,或者100~190mm,又或者100~160mm。
21、在另一可选例中,以缓冲系统的总重量体积百分比计,所述多元醇的浓度(w/v)为0.5%~20%,例如0.8%~10%,或者0.9%~5%。
22、在另一可选例中,以缓冲系统的总重量体积百分比计,所述表面活性剂的浓度(w/v)为0.0005%~0.002%,例如0.0008%~0.002%。
23、在另一可选例中,所述ph缓冲液的浓度为2~50mm,例如5~30mm,或者8~20mm。
24、在另一可选例中,所述可溶盐类物质中的可溶二价金属盐的浓度为0.2~8mm,例如0.5~5mm,或者0.8~2mm。
25、在另一可选例中,以缓冲系统的总重量体积百分比计,所述蔗糖的浓度(w/v)为0.5%~20%,例如0.8%~10%,或者0.9%~5%。
26、在另一可选例中,以缓冲系统的总重量体积百分比计,所述甘露醇的浓度(w/v)为0.5%~20%,例如1%~10%,或者2%~5%。
27、在另一可选例中,以缓冲系统的总重量体积百分比计,所述甘油的浓度(w/v)为0.5%~20%,例如1%~10%,或者2%~5%。
28、在另一可选例中,所述缓冲系统的渗透压为280~330mosm/kg。
29、在另一可选例中,所述缓冲系统的溶剂是有机溶剂或无机溶剂,可选地溶剂是无机溶剂,例如所述缓冲系统的溶剂是水。
30、在另一可选例中,所述缓冲系统还用于选自下组的一种或多种用途:
31、(a)防止病毒在低温、冷藏、常温及多次反复冻融过程中所引发的衣壳蛋白破碎、聚集及包装完整性的损伤;
32、(b)分散更多数量的病毒颗粒;
33、(c)保证在等渗透压,可实现更多的应用场景,避免高渗透压引起的不良反应。
34、本公开第二方面提供了一种本公开第一方面所述的缓冲系统的用途,用于制备一种试剂或试剂盒,所述试剂或试剂盒用于改善病毒颗粒的稳定及分散性。
35、在另一可选例中,所述试剂或试剂盒还用于选自下组的一种或多种用途:
36、(a)防止病毒在低温、冷藏、常温及多次反复冻融过程中所引发的衣壳蛋白破碎、聚集及包装完整性的损伤;
37、(b)分散更多数量的病毒颗粒;
38、(c)保证在等渗透压,可实现更多的应用场景,避免高渗透压引起的不良反应。
39、本公开第三方面提供了一种试剂盒,所述试剂盒包括:
40、i)一个或多个容纳相同或不同可溶盐类物质的容器;
41、ii)一个或多个容纳相同或不同多元醇的容器;
42、iii)一个或多个容纳相同或不同ph缓冲液的容器;
43、iv)任选的一个或多个容纳相同或不同表面活性剂的容器。
44、在另一可选例中,所述可溶盐类物质包括可溶一价金属盐。
45、在另一可选例中,所述可溶一价金属盐包括可溶钠盐。
46、在另一可选例中,所述可溶盐类物质包括可溶二价金属盐。
47、在另一可选例中,所述可溶二价金属盐包括可溶钙盐、可溶镁盐、可溶锌盐、可溶铜盐、可溶锰盐、可溶铬盐中的一种或多种。
48、在另一可选例中,所述多元醇包括蔗糖、甘露醇、甘油。
49、在另一可选例中,所述表面活性剂选自下组:f68、tween20、或其组合。
50、在另一可选例中,所述试剂盒还用于选自下组的一种或多种用途:
51、(a)防止病毒在低温、冷藏、常温及多次反复冻融过程中所引发的衣壳蛋白破碎、聚集及包装完整性的损伤;
52、(b)分散更多数量的病毒颗粒;
53、(c)保证在等渗透压,可实现更多的应用场景,避免高渗透压引起的不良反应。
54、在另一可选例中,所述的上述容器中的任何二个、三个、或四个(或全部)可以是相同(或同一)或不同容器。
55、在另一可选例中,所述上述容器中的任何二个或三个(或全部)可以是相同(或同一)或不同容器。
56、本公开第四方面提供了一种改善病毒颗粒的稳定及分散性的方法,包括:
57、提供本公开第一方面所述的缓冲系统,将病毒颗粒置于所述缓冲系统中从而改善病毒颗粒的稳定及分散性。
58、在另一可选例中,所述病毒颗粒包括aav病毒颗粒、慢病毒颗粒、或其组合。
59、本公开第五方面提供了一种液体制剂,所述制剂包括:
60、(i)治疗有效量的病毒颗粒;
61、(ii)可溶盐类物质;
62、(iii)多元醇;
63、(iv)ph缓冲液,
64、其中,所述制剂的ph为7.0~8.0(例如7.0~7.6,或者7.0~7.4)。
65、在另一可选例中,所述液体制剂还包括表面活性剂。
66、在另一可选例中,所述可溶盐类物质包括可溶一价金属盐。
67、在另一可选例中,所述可溶一价金属盐包括可溶钠盐。
68、在另一可选例中,所述可溶盐类物质包括可溶二价金属盐。
69、在另一可选例中,所述可溶二价金属盐包括可溶钙盐、可溶镁盐、可溶锌盐、可溶铜盐、可溶锰盐、可溶铬盐中的一种或多种。
70、在另一可选例中,所述多元醇包括蔗糖、甘露醇、甘油。
71、在另一可选例中,所述ph缓冲液选自下组的一种或任意几种缓冲液:pb缓冲液、hepes缓冲液。
72、在另一可选例中,所述表面活性剂选自下组:f68、tween20、或其组合。
73、在另一可选例中,所述病毒颗粒包括aav病毒、慢病毒颗粒。
74、在另一可选例中,所述病毒颗粒为aav病毒。
75、在另一可选例中,所述病毒颗粒为慢病毒颗粒。
76、在另一可选例中,所述病毒颗粒由腺相关病毒载体系统包装而成。
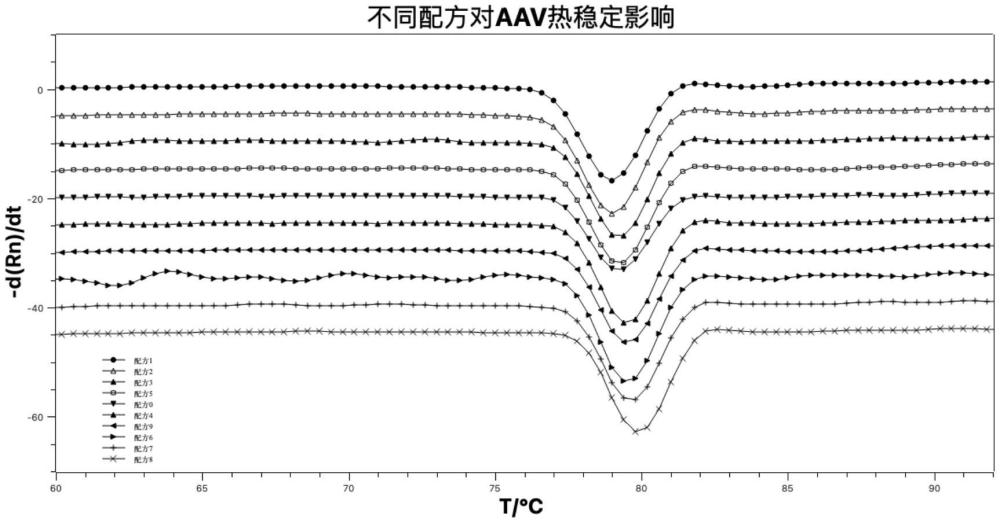
77、在另一可选例中,所述腺相关病毒载体系统的结构如专利申请号为202211254858.1/202310394646.1的专利中所述。
78、在另一可选例中,所述病毒颗粒的浓度为5×1011~5×1014vg/ml,例如2×1012~2×1014vg/ml,或者1×1013~1×1014vg/ml。
79、在另一可选例中,所述制剂渗透压为280~330mosm/kg。
80、在另一可选例中,所述制剂具有选自下组的一种或多种特征:
81、(a)所述制剂的聚集体含量<1.5%,例如<1.0%,或者<0.8%,或者<0.7%;
82、(b)所述制剂的游离核酸的含量<15ppm,例如<10ppm,或者<8ppm;
83、(c)所述制剂经过7天37℃加速破坏试验,病毒颗粒信号响应强度无明显降低,且病毒活性无显著下降;
84、(d)所述制剂经过7天加速试验,聚集体含量<1.5%,例如<1.0%,或者<0.8%。
85、在另一可选例中,所述制剂的聚集体含量为0.3%~1.5%,例如0.3%~1%,或者0.3%~0.7%。
86、在另一可选例中,所述制剂在7天加速试验后的游离核酸的含量为25ppm~35ppm。
87、在另一可选例中,所述制剂经过7天加速试验,聚集体含量为0.3%~0.7%。在另一可选例中,所述制剂包括:
88、(a)5×1011~5×1014vg/ml浓度的治疗有效量的病毒颗粒;
89、(b)50~250mm的可溶盐类物质;
90、(c)0.5%~20%(w/v)多元醇;
91、(d)2~50mm ph缓冲液;
92、并且所述制剂的ph为7.0~8.0。
93、在另一可选例中,所述制剂包括0.0005%~0.002%(w/v)的表面活性剂。
94、在另一可选例中,所述制剂包括:
95、(a)2×1012~2×1014vg/ml浓度的治疗有效量的病毒颗粒;
96、(b)80~200mm可溶盐类物质;
97、(c)0.8%~10%(w/v)多元醇;
98、(d)5~30mm ph缓冲液;
99、并且所述制剂的ph为7.0~7.6。
100、在另一可选例中,所述制剂包括0.0005%~0.002%(w/v)的表面活性剂。
101、在另一可选例中,所述制剂包括:
102、(a)1×1013~1×1014vg/ml浓度的治疗有效量的病毒颗粒;
103、(b)100~190mm可溶盐类物质;
104、(c)0.9%~5%(w/v)多元醇;
105、(d)8~15mm ph缓冲液;
106、并且所述制剂的ph为7.0~7.4。
107、在另一可选例中,所述制剂包括0.0008%~0.002%(w/v)的表面活性剂。
108、本发明本公开第六方面提供了本发明本公开第五方面所述制剂的用途,用于制备(i)预防和/或治疗遗传性凝血因子缺乏病的药物;和或(ii)预防和/或治疗高血脂相关疾病的药物。
109、在另一可选例中,所述遗传性凝血因子缺乏病为a型、b型或c型血友病。
110、在另一可选例中,所述遗传性凝血因子缺乏病为哺乳动物遗传性凝血因子缺乏病;可选的,所述遗传性凝血因子缺乏病为人遗传性凝血因子缺乏病。
111、在另一可选例中,所述高血脂相关疾病包括心血管病。
112、在另一可选例中,所述心血管病包括动脉粥样硬化性心血管疾病、家族性高胆固醇血症。
113、本公开第七方面提供了一种药盒,所述的药盒含有一种容器以及位于所述容器内的本公开第五方面所述的制剂。
114、本公开第八方面提供了一种制备稳定的改善病毒颗粒的稳定及分散性的液体制剂方法,包括步骤:
115、(a)将治疗有效量的病毒颗粒、可溶盐类物质、多元醇以及ph缓冲液进行混合;
116、(b)将混合后的混合物ph值调整至ph为7.0~8.0(例如,7.0~7.6,或者7.0~7.4);
117、从而获得一种稳定的改善病毒颗粒的稳定及分散性的液体制剂。
118、在另一可选例中,所述稳定的改善病毒颗粒的稳定及分散性的液体制剂具有选自下组的一种或多种特征:
119、(a)所述制剂的聚集体含量<1.5%,例如<1.0%,或者<0.8%;
120、(b)所述制剂的游离核酸的含量<15ppm,例如<10ppm,或者<8ppm;
121、(c)所述制剂经过7天37℃加速破坏试验,病毒颗粒信号响应强度无明显降低,且病毒活性无显著下降;
122、(d)所述制剂经过7天加速试验,聚集体含量<1.5%,例如<1.0%,或者<0.8%。
123、在另一可选例中,所述方法还包括将治疗有效量的病毒颗粒、可溶盐类物质、多元醇以及ph缓冲液与表面活性剂混合的步骤。
124、应理解,在本公开范围内中,本公开的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或可选的技术方案。限于篇幅,在此不再一一累述。
技术研发人员:吴昊泉,姜超,李欣然,代勇,胡晓东,苏玲玲
技术所有人:康霖生物科技(杭州)有限公司
备 注:该技术已申请专利,仅供学习研究,如用于商业用途,请联系技术所有人。
声 明 :此信息收集于网络,如果你是此专利的发明人不想本网站收录此信息请联系我们,我们会在第一时间删除
