包含塞替派的稳定制剂的制作方法
本公开涉及包含塞替派的组合物以及使用该组合物治疗受试者的疾病的方法。
背景技术:
1、塞替派是一种具有抗肿瘤特性的氮芥烷化剂。适用于治疗乳腺腺癌、膀胱浅表性乳头状癌、以及成人和儿童血液疾病(如霍奇金病或白血病)。塞替派也适用于控制继发于浆膜腔弥漫性或局部肿瘤性疾病的腔内积液。塞替派也用作同种异体或自体造血祖细胞移植前的调理治疗,或用于缓解肿瘤性疾病。
2、塞替派在水性溶液中通常是不稳定的,这导致在储存后产生杂质和/或塞替派降解产物。水性不稳定性使得塞替派的即用型(ready-to-use)液体剂型难以储存。
3、它通常可作为不含赋形剂的冻干产品(15mg至100mg)在无菌注射用水中被重构为10mg/ml的浓度。当静脉内提供时,塞替派可按照2-4小时输注,剂量范围为3.24-14mg/kg/天,累积剂量为1050mg/m2(42mg/kg)来提供,以治疗实体瘤。
4、us2014/0005148描述了氮芥(包括塞替派)的非水性制剂。氮芥容易受到水和其它水性溶剂(如乙醇)的亲核攻击,从而将氮芥降解为降解产物。
5、ep 0 419 890报告了包含聚乙二醇(peg)的冻干的和无水的塞替派组合物。这篇参考文献报道了,在水中重构的塞替派应在5天内使用,因为重构的塞替派储存超过5天显示出效力大幅丧失。
6、us2020/0163979描述了药学上可接受的、包含塞替派的可注射液体制剂,其包含至少一种溶剂或共溶剂,例如乙醇。据报道,在25℃/60%相对湿度下储存7天后,含有乙醇的组合物具有至少90%纯度的塞替派。
技术实现思路
1、本节提供了公开的一般概述,而不是对其全部范围或其特征的全部的全面公开。
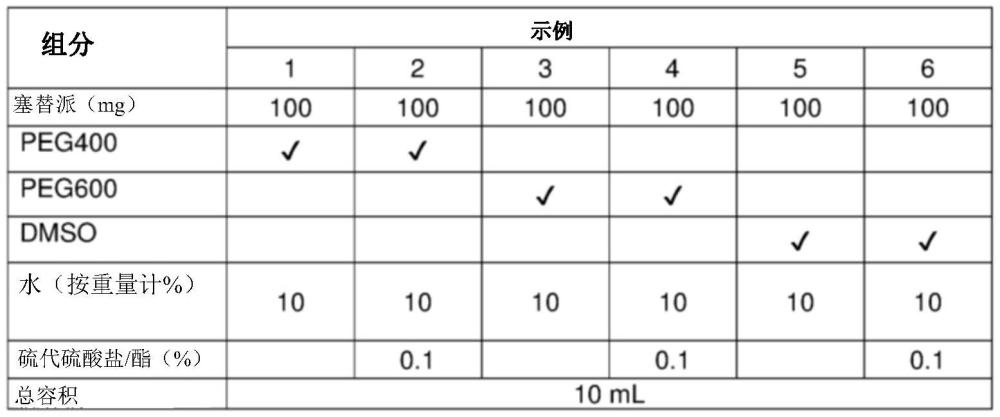
2、本公开涉及包含塞替派、peg或dmso以及水的组合物。在实施方式中,所述组合物不含杂质或基本上不含杂质。本公开的组合物是稳定的并且可适合于注射。在实施方式中,塞替派制剂可用于治疗疾病(特别是癌症)或骨髓移植前的骨髓细胞清除(myeloablation)。
3、在实施方式中,所述塞替派组合物包含peg,例如peg400或peg600。在另一实施方式中,所述组合物包含dmso。
4、在替代实施方式中,所述组合物是无水组合物,所述无水组合物包含塞替派和溶剂,所述溶剂例如为dmso、peg400、peg600、dma和nmp,其中,所述组合物不含或基本上不含杂质。
5、在实施方式中,所述组合物进一步包含硫代硫酸盐/酯。
6、在实施方式中,提供了用于治疗受试者的癌症的方法,所述方法包括注射施用包含塞替派、peg或dmso、和水的组合物。在又一实施方式中,所述peg是peg400或peg600。在具体的实施方式中,所施用的组合物进一步包含硫代硫酸盐/酯。
7、在另一实施方式中,提供了用于在骨髓移植前对受试者进行骨髓细胞清除的方法,所述方法包括施用所述塞替派组合物。
8、在另一实施方式中,提供了用于增强塞替派制剂稳定性的方法。
技术特征:
1.一种组合物,所述组合物包含塞替派、水和赋形剂,
2.根据权利要求1所述的组合物,其中,所述塞替派以约10mg/ml的量存在。
3.根据权利要求1或2所述的组合物,其中,所述赋形剂是peg400或peg600。
4.根据权利要求1-3中任一项所述的组合物,其中,所述赋形剂是dmso。
5.根据权利要求1-4中任一项所述的组合物,其中,所述水以选自于由至多约30%、至多约25%、至多约20%、至多约15%、至多约10%和至多约5%所组成的组中的量存在。
6.根据权利要求5所述的组合物,其中,所述水以至多约10%的量存在。
7.根据权利要求1-6中任一项所述的组合物,其中,所述杂质以选自于由少于约100ppm、少于约35ppm、少于约30ppm、少于约25ppm、少于约20ppm、少于约15ppm、少于约10ppm和少于约5ppm所组成的组中的量存在。
8.根据权利要求1-7中任一项所述的组合物,其中,所述杂质以选自于由约1ppm至约100ppm之间、约1ppm至约35ppm之间、1ppm至约30ppm之间、1ppm至约25ppm之间、1ppm至约20ppm之间、1ppm至约15ppm之间、1ppm至约10ppm之间以及1ppm至约5ppm之间所组成的组中的量存在。
9.根据权利要求1-8中任一项所述的组合物,其中,所述杂质是以下中一种或多种:
10.根据权利要求9所述的组合物,其中,所述组合物包含:
11.根据权利要求1-10中任一项所述的组合物,所述组合物进一步包含硫代硫酸盐/酯。
12.根据权利要求11所述的组合物,其中,所述硫代硫酸盐/酯以约0.01%至约1.0%之间的量存在。
13.根据权利要求11或12所述的组合物,其中,所述硫代硫酸盐/酯以约0.1%的量存在。
14.根据权利要求1所述的组合物,所述组合物由以下组成:塞替派、peg400、水、以及
15.根据权利要求14所述的组合物,所述组合物包含约10mg/ml塞替派和按重量计为约10%的水。
16.根据权利要求1所述的组合物,所述组合物由以下组成:塞替派、peg600、水、以及
17.根据权利要求16所述的组合物,所述组合物包含约10mg/ml塞替派和按重量计为约20%的水。
18.根据权利要求1所述的组合物,所述组合物由以下组成:塞替派、dmso、水、以及
19.根据权利要求11所述的组合物,所述组合物包含约10mg/ml塞替派和按重量计为约10%的水。
20.根据权利要求1-19中任一项所述的组合物,所述组合物进一步包含生育酚。
21.根据权利要求1所述的组合物,其中,所述赋形剂为peg400并且所述组合物具有小于约1.0meq o2/kg脂肪的过氧化值。
22.根据权利要求21所述的组合物,其中,所述过氧化值小于约0.5meq o2/kg脂肪。
23.一种无水组合物,所述无水组合物包含塞替派和溶剂,
24.根据权利要求23所述的组合物,其中,所述杂质以选自于由少于约35ppm、少于约30ppm、少于约25ppm、少于约20ppm、少于约15ppm、少于约10ppm和少于约5ppm所组成的组中的量存在。
25.根据权利要求23或24所述的组合物,其中,所述杂质以选自于由约1ppm至约35ppm之间、1ppm至约30ppm之间、1ppm至约25ppm之间、1ppm至约20ppm之间、1ppm至约15ppm之间、1ppm至约10ppm之间以及1ppm至约5ppm之间所组成的组中的量存在。
26.根据权利要求23-25中任一项所述的组合物,其中,所述杂质是以下中的一种或多种:
27.根据权利要求23-26中任一项所述的组合物,其中,所述组合物包含:
28.根据权利要求23-27中任一项所述的无水组合物,所述无水组合物进一步包含抗氧化剂或有机碱。
29.根据权利要求23-28中任一项所述的无水组合物,其中,所述抗氧化剂是生育酚。
30.根据权利要求23-29中任一项所述的无水组合物,其中,所述有机碱是tris碱。
31.一种用于治疗有需要的受试者的癌症的方法,所述方法包括向所述受试者施用如权利要求1-30中任一项所述的组合物。
32.根据权利要求31所述的方法,其中,所述癌症选自于由膀胱癌、恶性脑膜赘生物、乳腺癌和卵巢癌所组成的组。
33.根据权利要求31或32所述的方法,其中,所述组合物通过注射施用。
34.根据权利要求33所述的方法,其中,所述注射选自于由皮下注射、肌内注射、静脉内注射、输注、腹膜内注射、胸膜内注射、心包内注射、鞘内注射、动脉内注射、膀胱内注射和病灶内注射所组成的组。
35.根据权利要求31-34中任一项所述的方法,所述方法包括施用约300mg和约700mg的塞替派。
36.根据权利要求31-35中任一项所述的方法,其中,所述塞替派是稳定的。
37.一种用于有需要的受试者的骨髓移植前的骨髓细胞清除的方法,所述方法包括:
38.一种用于增强塞替派制剂的稳定性的方法,所述方法包括:
39.根据权利要求38所述的方法,其中,所述塞替派浓度为约10mg/ml。
40.根据权利要求38或39所述的方法,其中,所述水按重量计占所述组合物的约10%或约20%。
41.根据权利要求38-40中任一项所述的方法,其中,所述peg是peg400或peg600。
42.根据权利要求38-41中任一项所述的方法,其中,所述塞替派制剂由10mg/ml的塞替派、peg400和按重量计为10%的水组成。
43.根据权利要求38-42中任一项所述的方法,其中,所述塞替派制剂由10mg/ml的塞替派、peg600和按重量计为20%的水组成。
44.根据权利要求38-43中任一项所述的方法,其中,所述塞替派制剂由10mg/ml的塞替派、dmso和按重量计为10%的水组成。
45.根据权利要求38-44中任一项所述的方法,所述方法进一步包括向所述组合物添加硫代硫酸盐/酯。
46.根据权利要求45所述的方法,其中,所述硫代硫酸盐/酯按重量计占约0.01%到约10%。
47.根据权利要求46所述的方法,其中,所述硫代硫酸盐/酯按重量计占约0.1%。
技术总结
本公开提供了药物组合物,所述药物组合物包含塞替派、水、选自PEG中的一种(如PEG400或PEG600)和DMSO,以及任选的硫代硫酸盐/酯,或者此类不含或基本上不含杂质的组合物。还提供了使用所述组合物治疗受试者的癌症或者在骨髓移植前进行骨髓细胞清除的方法。还考虑了用于增强塞替派制剂的稳定性的方法。
技术研发人员:莎伦·坎宁翰,奥莱斯·瑞安,约翰尼斯·简·普拉泰尤
受保护的技术使用者:肖拉制药公司
技术研发日:
技术公布日:2024/12/2
技术研发人员:莎伦·坎宁翰,奥莱斯·瑞安,约翰尼斯·简·普拉泰尤
技术所有人:肖拉制药公司
备 注:该技术已申请专利,仅供学习研究,如用于商业用途,请联系技术所有人。
声 明 :此信息收集于网络,如果你是此专利的发明人不想本网站收录此信息请联系我们,我们会在第一时间删除
