一种基于多肽-金团簇的纳米电化学传感器及其制备方法和应用
本发明涉及电化学传感领域,具体涉及一种基于多肽-金团簇的纳米电化学传感器及其制备方法和应用。
背景技术:
1、金属团簇是介于分子和纳米粒子尺度之间的一类凝聚态物质,其大小由几个到几十个原子组成,尺寸一般小于2nm。由于其独特的电子和几何结构,金属团簇表现出既不同于纳米粒子也不同于小分子的独特的物理化学性能。同时,由于金属团簇表面配位数较少,具有高活性比表面积,在电化学和电分析传感领域具有重要的应用价值,因此近年来其被用作一种新兴的电化学传感纳米材料。
2、近年来,为了在单细胞水平上更高效、灵敏地实现分子的定性或定量检测,已经发展出多种单细胞分析手段,比如超高分辨单细胞荧光分析技术、微流控技术、毛细管电泳技术、质谱技术、流式细胞技术、电化学分析技术等。其中微流控技术和毛细管电泳技术都具有很高的分离效率,并且进样体积小,试剂消耗少,但也存在样品前处理复杂,分析成本较高的问题。质谱法具有高灵敏度、高选择性的优点,其中有机质谱在单细胞分析领域已占有越来越重要的地位,具有分析范围广、选择性高的优势,且更适用于未知样品的检测。但目前单细胞质谱法的难点在于缺乏对单细胞水平上的信号分子进行实时动态监测的手段。流式细胞术具有检测速度快、精度高、准确性好等优势。但是流式细胞术只能分析悬浮状态的单细胞,且对细胞数量有一定的要求,并且也无法给出具有高空间分辨率的结果,这也在一定程度上限制了它的应用。
3、因此,目前迫切需要开发一种精准、快速、灵敏、准确、高选择性和高空间分辨率的单细胞生物标志物分析方法。
技术实现思路
1、为此,本发明提供一种基于多肽-金团簇的纳米电化学传感器及其制备方法和应用,以解决上述的问题。
2、由于单细胞电化学分析方法不需要以牺牲时间分辨率为代价提高空间分辨率,因此具有高时空分辨率的分析优势。且随着纳米电极以及纳米电化学理论的快速发展,电化学测量的灵敏度和特异性显著提高,因此单细胞电化学分析方法作为一种可靠的、具有高时空分辨率的分析工具非常适用于对单细胞内生物标志物进行分析检测。
3、为了实现上述目的,本发明提供如下技术方案:
4、根据本发明第一方面提供的一种基于多肽-金团簇的纳米电化学传感器的制备方法,所述方法包括:
5、步骤一,制备能够被组织蛋白酶b特异性酶切的多肽-金团簇,其中,所述多肽-金团簇含有能被组织蛋白酶b特异性酶切的底物肽;
6、步骤二,基于多肽-金团簇的纳米电化学传感器的构建
7、以镀金纳米电极为工作电极,ag/agcl为参比电极,铂片电极为对电极,在含haucl4,kno3的电解质溶液中,施加负压,扫描100~300s,用纯水彻底清洗后,得到aunps/aune电极;
8、将aunps/aune电极浸泡于巯基苯甲醛(mb)溶液中,室温孵育6~12h以完成mb分子在金电极表面的自组装;用纯水彻底清洗未组装的mb分子后,室温晾干;
9、将电极浸入6-巯基-1-己醇(mch)溶液中以封闭电极表面的非特异性位点,室温孵育后纯水彻底清洗,并将电极标记为mch/mb/aunps/aune,室温晾干;
10、将上述mch/mb/aunps/aune电极浸入多肽-金团簇溶液中,使多肽-金团簇共价修饰到纳米电极表面,得到aucs/mch/mb/aunps/aune电极,即为基于多肽-金团簇的纳米电化学传感器。
11、进一步的,所述步骤一中,多肽-金团簇的制备方法包括:
12、步骤一,在37℃下,将多肽溶于超纯水中配制成1~2mm多肽溶液置于干净干燥的材料反应瓶中,水浴加热反应,得到多肽溶液;
13、步骤二,将haucl4溶液和naoh溶液依次逐滴滴入上述多肽溶液中,调节ph值到12,所形成的溶液继续在37℃下继续搅拌,超滤得到多肽-金团簇。
14、进一步的,所述步骤一中,组织蛋白酶b的特异性酶切底物多肽序列为:如seq idno.1所示的h2n-ccyffgflgkkkkk-cooh或如seq id no.2所示的h2n-ffgflgkkkkkycc-cooh。
15、进一步的,所述步骤二中,镀金纳米电极的尖端直径为450-550nm。
16、进一步的,所述步骤二中,haucl4为5mm,kno3为0.5m,巯基苯甲醛为1mm,6-巯基-1-己醇为0.01m。
17、进一步的,所述步骤二中,负压采用-0.4v。
18、根据本发明第二方面提供的一种基于多肽-金团簇的纳米电化学传感器,是由如上方法制备而成。
19、根据本发明第三方面提供的一种如上所述的基于多肽-金团簇的纳米电化学传感器在制备分析单个肿瘤活细胞内组织蛋白酶b的含量中的应用,所述含量检测的方法包括先建立标准曲线,利用单细胞分析仪,借助显微操作平台将金纳米电极尖端深入肿瘤细胞内,孵育以完成酶切反应;缓慢撤出纳米金电极尖端,彻底清洗后在相同的测试条件下进行dpv测试;将dpv峰电流代入电化学分析标准曲线,分析获知单细胞胞浆内组织蛋白酶b的含量。
20、根据本发明第四方面提供的一种如上所述的基于多肽-金团簇的纳米电化学传感器在在制备分析单个肿瘤活细胞内组织蛋白酶b相对活性中的应用,所述相对活性的检测方法包括将采用组织蛋白酶b抑制剂组处理的dpv峰电流与未用组织蛋白酶b抑制剂处理的峰电流进行对比,获知组织蛋白酶b相对活性。
21、在一些实施方案中,所述电化学分析单个肿瘤活细胞内组织蛋白酶b含量或分析单个肿瘤活细胞内组织蛋白酶b相对活性的检测方法为:
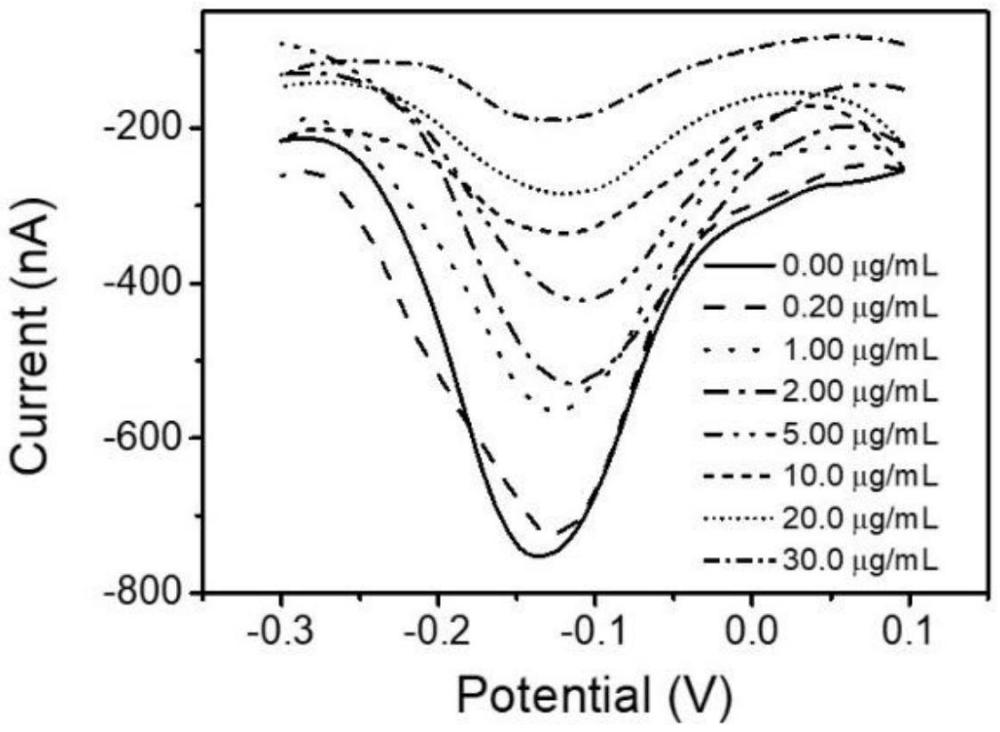
22、标准曲线的建立:对于标准曲线组,将修饰有多肽-金团簇的金纳米电极在含有h2o2和对苯二酚(hq)的电解质溶液中采用差分脉冲伏安法(dpv)检测相应的峰电流信号,得到空白对照电流i0。然后,将修饰有多肽-金团簇的金纳米电极浸泡入一系列不同浓度(0.20、1.00、2.00、5.00、10.0、20.0、30.0μg ml-1)的标准组织蛋白酶b溶液中,37℃孵育,完成酶切反应后,彻底清洗纳米金电极的尖端。在相同条件下进行dpv测试,测得电流i,以此dpv峰电流与对照组峰电流的变化(i-i0)/i0与组织蛋白酶b浓度的对数做线性拟合,绘制标准曲线。
23、对于单细胞内组织蛋白酶b的检测,利用单细胞分析仪,借助显微操作平台将金纳米电极尖端深入肿瘤细胞内,孵育3min以完成酶切反应,然后缓慢撤出纳米金电极尖端,彻底清洗后在相同的测试条件下进行dpv测试。将dpv峰电流代入电化学分析标准曲线,分析获知单细胞胞浆内组织蛋白酶b的含量。
24、对于细胞内组织蛋白酶b相对活性检测,将采用组织蛋白酶b抑制剂组处理的dpv峰电流与未用组织蛋白酶b抑制剂处理的峰电流进行对比,获知组织蛋白酶b相对活性。
25、进一步的,所述的肿瘤活细胞是乳腺癌mda-mb-231细胞或mcf-7细胞。
26、本发明具有如下优点:
27、(1)本发明以用特异性良好的底物多肽为模板合成的多肽-金团簇作为分子识别探针,使之能够被肿瘤细胞中的组织蛋白酶b特异性酶切,提高了纳米电化学传感器的选择性。
28、(2)本发明利用与抗体靶向性和特异性类似但更加稳定性的多肽合成金团簇,作为材料修饰电极,避免了传统电化学免疫传感器修饰过程中抗原抗体的活性降低,影响测试方法灵敏度的问题;本发明所采用的多肽序列,其特异性识别序列和矿化序列自然集成,不需要其他化学修饰或连接即可合成团簇探针,制备步骤简单,成本低廉,所需试剂量少。
29、(3)本发明利用dpv作为电化学信号的输出方式,该技术本身能够降低背景电流,提高电化学测试的灵敏度。
30、(4)本发明通过在电极表面电镀金纳米颗粒,提升了电极粗糙度,增大了电极表面活性面积,提高了导电性,增强了多肽-金团簇探针在电极表面的富集,大大提升了分析方法的灵敏度。
31、(5)鉴于细胞的异质性,本发明利用了单个细胞逐个分析的方法,区别于群体细胞检测,在单细胞水平对活细胞内组织蛋白酶b进行分析,能够获得更准确、全面的信息,更具有针对性。
技术研发人员:高靓,韩莹,高学云,段宇萌
技术所有人:北京工业大学
备 注:该技术已申请专利,仅供学习研究,如用于商业用途,请联系技术所有人。
声 明 :此信息收集于网络,如果你是此专利的发明人不想本网站收录此信息请联系我们,我们会在第一时间删除
